高考化学常考的知识点有哪些?
〖Ⅰ〗、高考化学主要考察以下知识点:化学基本概念和基本理论:包括物质分类、元素周期律、化学反应与能量、化学平衡、水溶液中的离子平衡、电化学等。元素化合物知识:考察学生对常见元素的单质及其重要化合物性质的了解程度,包括它们的物理性质、化学性质、制备方法等。
〖Ⅱ〗、高中化学主要考以下知识点:盐的水解的本质及表示方法。离子反应的本质、离子共存的分析、离子浓度的大小比较。关于氧化还原反应的分析、简单的配平与基本计算。关于电化学的分析。反应热、热化学方程式、盖斯定律及应用。同分异构体的分析与判断。
〖Ⅲ〗、物质的性质和变化:这是化学学科的基础,包括物质的物理性质(如颜色、形状、密度等)和化学性质(如氧化性、还原性、酸碱性等)。考生需要掌握常见物质的性质和变化规律,以及它们之间的相互关系。 化学反应方程式:化学反应方程式是描述化学反应过程的数学表达式,包括反应物、生成物和反应条件。
高中化学知识点归纳总结
〖Ⅰ〗、卤素单质一般不与稀有气体反应,但F2却能与Xe、Kr等稀有气体反应生成对应的氟化物,如 KrFXeFXeFXeF6 等。
〖Ⅱ〗、常温下其单质有颜色气体的元素是F、Cl。单质与水反应最剧烈的非金属元素是F。其比较高价氧化物的水化物酸性最强的元素是Cl。其单质是最易液化的气体的元素是Cl。其氢化物沸点比较高的非金属元素是O。其单质是最轻的金属元素是Li。常温下其单质呈液态的非金属元素是Br。
〖Ⅲ〗、⑨ 了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
〖Ⅳ〗、电子层结构相同的离子,核电荷数越多,离子半径越小。氧化性:MnO4- Cl2 Br2 Fe3+ I2 S=4(+4价的S)。例:I2 +SO2 + H2O = H2SO4 + 2HI。有Fe3+的溶液一般呈酸性。能形成氢键的物质:H2O、NHHF、CH3CH2OH。
高中常考的化学常识
无机部分包括框图题:突破口(特征反应、特殊现象、特殊颜色、重复出现的物质、特殊反应条件、特殊量的关系);推断题:物质结构(核外电子排布、晶体性质)、典型物质的化学性质等;方程式的书写:审题(离子方程式或化学方程式)、充分利用信息写出并配平(先氧化还原,再电荷守恒,后质量守恒)。
.氢离子的氧化性属于酸的通性,即任何可溶性酸均有氧化性。 2.不是所有的物质都有化学键结合。如:稀有气体。 3.不是所有的正四面体结构的物质键角为109。28, 如:白磷。 5.电解质溶液导电,电解抛光,等都是化学变化。
.卤水、石灰水、银氨溶液、Cu(OH)2悬浊液等,都要随配随用,不能长时间放置。 高中化学易错知识点 同种元素组成的物质不一定是单质,同种元素组成的物质也不一定是纯净物。因为可以是同种元素组成的几种单质的混合物。如由碳元素组成的金刚石、石墨等同素异形体的混合物。
高考化学与生活常考知识点
〖Ⅰ〗、新电灯泡的玻璃上常有一点暗红物质以除去灯泡内残留的氧,该物质是红磷。田径比赛发令枪打响后,产生的白烟主要是五氧化二磷。铜器表面慢慢形成一层铜绿:铁匠将烧红的生铁放在铁砧上反复锤打,使生铁转化为钢。
〖Ⅱ〗、二氧化硫能杀灭霉菌和细菌,可用作食物和干果的防腐剂,常见的防腐剂有苯甲酸钠、亚硝酸盐、二氧化硫等。生吃新鲜蔬菜比熟吃蔬菜更有利于获取维生素C。将煤进行气化或液化处理,可提高煤的综合利用率,减少二氧化硫的排放。
〖Ⅲ〗、油脂不是高分子化合物。糖类物质并非都能水解,如单糖。维生素c是一种水溶性维生素,是一种较强的还原剂,具有酸性。加碘盐中所加的是kio3,不是ki,也不是i2。可以使淀粉溶液变蓝的是i2,不是ki,也不是kio3。蛋白质为酸性食物,蔬菜水果等为碱性食物。
高中化学的重要知识点
化学与环境保护。 化学与健康医疗。 化学材料在生活中的应用。 化学能源的开发与利用。化学理论在生产中的应用 化工生产原理及工艺流程。 化学分析在工业生产中的应用。 新材料、新工艺的研发与应用趋势。 化学技术在提高生产效率中的作用。
元素周期表、元素周期律、氧化还原反应、离子反应、热化学方程式等。化学元素周期表是根据核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体,非金属,过渡元素等。
高中化学知识点:氢离子的氧化性属于酸的通性,即任何可溶性酸均有氧化性。不是所有的物质都有化学键结合。如:稀有气体、电解质溶液导电、电解抛光等都是化学变化。有单质参加或生成的反应不一定为氧化还原反应,氟元素既有氧化性也有还原性。
高三化学合格考的知识点归纳 有机物的不饱和度 不饱和度又称缺氢指数,是有机物分子不饱和程度的量化标志,用希腊字母Ω表示。规定烷烃的不饱和度是0(所有的原子均已饱和)。不饱和度是计算有机物的分子式和推导有机物的结构式的相当有用的工具。
高中化学必考知识点总结 ( 1)物质的组成、性质和分类 ① 了解分子、原子、离子和原子团等概念的含义。② 理解物理变化与化学变化的区别与联系。③ 理解混合物和纯净物、单质和化合物、金属和非金属的概念。④ 理解酸、碱、盐、氧化物的概念及其相互联系。
高中化学知识点 答案:基本概念与化学用语 元素周期表的结构及元素性质变化规律。 化学键的类型:离子键、共价键、金属键。 化学式的书写及化学方程式的平衡。化学反应速率与化学平衡 化学反应速率的影响因素。 化学平衡状态的判断及移动规律。
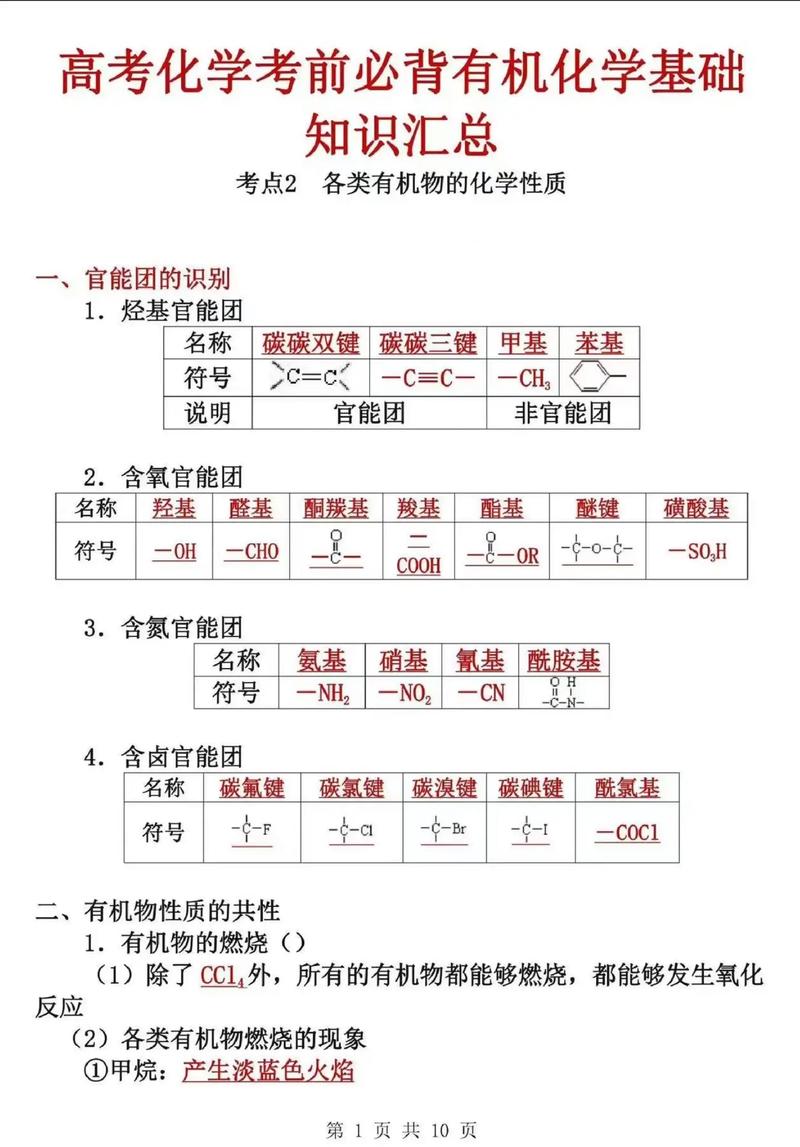
高中化学必考327个知识点
〖Ⅰ〗、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。有刺激性气味的气体:HF、HCl、HBr、HI、NHSONOFClBr2(g);有臭鸡蛋气味的气体:H2S。
〖Ⅱ〗、原子电子层数多的其半径大于电子层数少的,但锂的原子半径大于铝的原子半径。(周期律通常我们都是学习三周期,当把不同周期的元素放在一起比较的时候,规律就可能乱套了)主族元素的比较高正价一般等于其族序数,但O2和F2却不是。
〖Ⅲ〗、高中化学必考知识点有哪些 化学现象: 铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的。 Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红) 焰色反应:Na黄色、K紫色(透过蓝色的钴玻璃)、Cu绿色、Ca砖红、Na+(黄色)、K+(紫色)。
〖Ⅳ〗、高中化学必考知识 镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。木炭在氧气中燃烧:发出白光,放出热量。硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
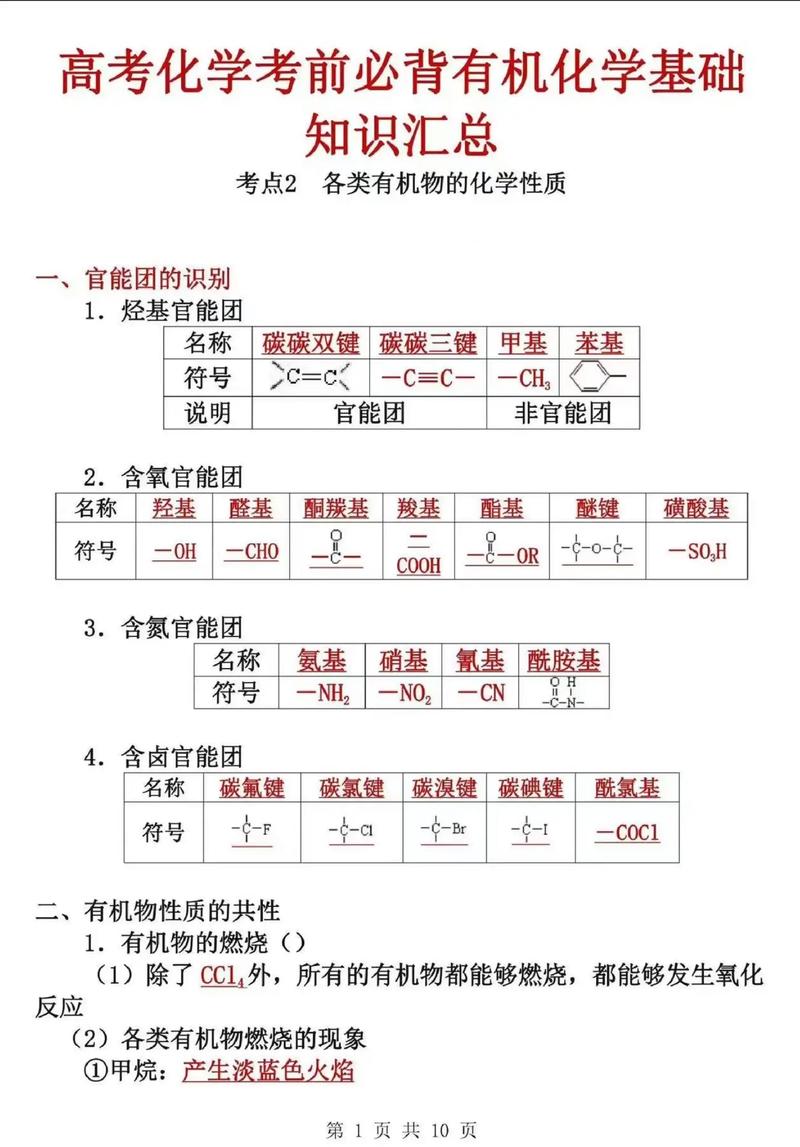
高中化学必考基础知识大全
〖Ⅰ〗、⑨ 了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
〖Ⅱ〗、高中化学必背基础知识有:常见物质的颜色:有色气体单质:F2(浅黄绿色)、Cl2(黄绿色)、O3(淡蓝色)。
〖Ⅲ〗、无色气体单质:NOH希有气体单质。有色气体化合物:NO2。黄色固体:S、FeS2(愚人金,金黄色)、Na2OAg3POAgBr、AgI。黑色固体:FeO、Fe3OMnOC、CuS、PbS、CuO(最常见的黑色粉末为MnO2和C)。
〖Ⅳ〗、学好高中化学需要打好基础:高一的元素周期表、氧化还原反应;高二的化学平衡、电离平衡、有机化学及典型元素等,都是学好化学必不可少的知识。
〖Ⅴ〗、高中化学会考必背知识点:物质结构理论 、化学反应速率和化学平衡理论 、化学实验安全等。物质结构理论 用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小。

高中化学的知识点,要常考的
〖Ⅰ〗、高中化学主要考以下知识点:盐的水解的本质及表示方法。离子反应的本质、离子共存的分析、离子浓度的大小比较。关于氧化还原反应的分析、简单的配平与基本计算。关于电化学的分析。反应热、热化学方程式、盖斯定律及应用。同分异构体的分析与判断。
〖Ⅱ〗、学好高中化学需要打好基础:高一的元素周期表、氧化还原反应;高二的化学平衡、电离平衡、有机化学及典型元素等,都是学好化学必不可少的知识。
〖Ⅲ〗、萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法;选取的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂;用四氯化碳萃取溴水里的溴、碘。
〖Ⅳ〗、高三化学合格考的知识点归纳SO2的性质:强的还原性、漂白性、弱的氧化性、酸性氧化物。SO2通入氯化钡、氯化钙溶液都没有沉淀。但是通入硝酸钡溶液有沉淀。因为SO2在水溶液中生成亚硫酸,亚硫酸电离出氢离子与硝酸根构成硝酸,可以氧化SO2氧化成硫酸根离子,生成硫酸钡沉淀。
〖Ⅴ〗、高中化学会考必背知识点:物质结构理论 、化学反应速率和化学平衡理论 、化学实验安全等。物质结构理论 用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小。
高中常考化学常识和高中常考化学常识汇总的问题分享结束啦,以上的文章解决了您的问题吗?欢迎您下次再来哦!

发表评论